El carbono es un elemento único en la naturaleza ya que tiene la cualidad de formar un número muy grande de compuestos. Se encuentra libre en la corteza terrestre en diferentes formas alotrópicas y también formando compuestos. En la atmósfera podemos hallarlo en el dióxido y monóxido de carbono.
Una característica importante del carbono es la extensa variedad de compuestos que forma cuando se combina con hidrógeno, oxígeno, nitrógeno y otros elementos, que se les conoce como compuestos orgánicos.
Ubicación en la tabla periódica
El carbono es el primer elemento de la familia IV A de los elementos representativos y es un no metal. Se une químicamente con otros elementos para formar compuestos inorgánicos, como carburos, óxidos y sales; pero también forma una inmensa gama de compuestos orgánicos.
Estructura química
Hay dos modelos que se complementan para explicar la estructura atómica del carbono. El Modelo de Bohr y el Modelo de puntos de Lewis que se muestran a continuación:
Enlaces que forma el carbono
Esta figura muestra los enlaces covalentes que se pueden formar entre los átomos de C mediante la compartición de electrones, aunque también se muestran electrones sin pareja que pueden establecer otros enlaces. En las estructuras desarrolladas de los diferentes compuestos orgánicos es común visualizar el par de electrones que se comparte como una línea que une los símbolos.
Hidrocarburos
Los átomos de carbono se enlazan químicamente entre sí formando largas cadenas lineales o ramificadas, debido a esta característica se considera al carbono, único en la naturaleza, lo que le permite formar una inimaginable cantidad de compuestos; a esta propiedad del carbono se conoce como concatenación.
Los enlaces carbono-carbono pueden ser simples, dobles o triples. En las fórmulas desarrolladas de los compuestos orgánicos los átomos de C invariablemente tendrán cuatro enlaces representados mediante líneas; por otro lado, el átomo de hidrógeno al combinarse químicamente sólo puede formar un enlace que se representa con una sola línea:
Clasificación de hidrocarburos
Fórmulas y Nomenclatura de HC
Existen varias formas de representar las estructuras de los HC y cada una tiene sus propias reglas de construcción. Las más comunes son: la desarrollada, la semidesarrollada, de esqueleto, de esferas y palos, y condensada.
Desarrollada: Se representan todos los átomos de carbono e hidrógeno y sus enlaces en una estructura plana.

Semidesarrollada: Se agrupan los hidrógenos al átomo de carbono con el que se encuentran enlazados.

De esqueleto: Consiste en trazar líneas en zig-zag, donde los vértices y los extremos representan átomos de carbono unidos mediante líneas sencillas, dobles o triples, y los hidrógenos no se representan.
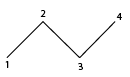
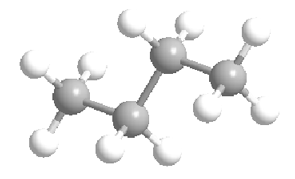
De esferas y palos: En este modelo los átomos son esferas compactas que se unen mostrando el acomodamiento espacial más probable de los átomos de carbono e hidrógeno.
Condensada: En ésta se agrupan todos los átomos de carbono e hidrógeno, es útil para ver la composición pero no la estructura.
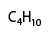
Nomenclatura de hidrocarburos
El número de átomos de carbono que contienen las moléculas de los hidrocarburos está relacionado con su nombre, de acuerdo a la Unión Internacional de Química Pura y Aplicada (IUPAC) se deben utilizar las raíces griegas para indicar el número de átomos que forman una cadena o una ramificación.
Para nombrar un hidrocarburo lineal de cadena abierta:
1. Se cuenta el número de átomos de carbono y se elige la raíz griega correspondiente.
2. Se identifica el tipo de enlaces que hay; sencillo, doble o triple; para dar la terminación del nombre.
3. Si hay enlace doble o triple, se enumeran los átomos de carbono asignándole la menor posición al enlace múltiple.
4. Se nombra el HC empezando por la posición del enlace doble o triple y posteriormente se escribe el nombre de la cadena principal.
Para nombrar un HC de cadena abierta ramificada:
1. Se cuenta el número de átomos de carbono de la cadena más larga y, en su caso, que contenga el enlace doble o triple, se enumeran los átomos de carbono asignándole la menor posición al enlace múltiple para asignarle nombre a la cadena principal.
2. Se identifican las ramificaciones y el número de átomos de carbono que las forman para asignarles nombre, se utilizan las mismas raíces griegas pero se les da terminación - il
3. Se nombra la estructura enlistando las ramificaciones en orden alfabético indicando su posición, y posteriormente se nombra la cadena principal.
Compuestos de carbono
El carbono puede formar una amplia gama de compuestos enlazándose con otros elementos además del hidrógeno; de esta forma es posible encontrarlo formando compuestos con oxígeno, con nitrógeno o con azufre, o bien, con diferentes elementos a la vez.
Isomería
El carbono al unirse a otros átomos de carbono produce una gran variedad de compuestos. A partir de 4 átomos de carbono podemos encontrar dos o más compuestos que tienen la misma fórmula molecular o condensada, sin embargo, sus estructuras no son iguales.
Estos compuestos reciben el nombre de isómeros, que tienen la misma composición atómica pero diferente fórmula estructural, por esto es necesario conocer la fórmula desarrollada o semi desarrollada, para saber qué tipo de compuesto es y poderlo diferenciar del otro, además la estructura podrá ayudar a explicar mejor las propiedades de cada isómero.
Entre mayor sea el número de átomos en un compuesto, mayores son las posibilidades de formar diferentes isómeros.
Relación entre estructura de las moléculas y las propiedades de los compuestos
Así como las formas alotrópicas del carbono presentan diferentes propiedades, los isómeros también presentan diferentes propiedades debido a su estructura. Ejemplos:
Referencias: